


Por: Dra. Daniela Hozbor
La incidencia de la enfermedad de origen viral transmitida por el mosquito Aedes aegypti, conocida como dengue, ha aumentado considerablemente en las últimas dos décadas, a nivel mundial. Sin embargo, es en América donde se registra el 80% del total de los casos mundiales.
En el año 2023, se registró el mayor número de casos de dengue en esta región, con un total de 4.565.911, de los cuales 7.653 (0,17%) fueron casos graves y 2.340 resultaron en fallecimiento, con una tasa de letalidad del 0,051%.
Esta situación de alta transmisión continúa en 2024, con 673.267 casos de dengue notificados durante las primeras cinco semanas del año. De estos, 700 casos fueron graves (0,1%) y se registraron 102 casos fatales con una tasa de letalidad del 0.015%. Teniendo en cuenta este comportamiento de la enfermedad caracterizado por un aumento exponencial de casos notificados en varios países de la región de las Américas, el cual sucede a un año en el que se registró el mayor número de casos de dengue reportado en las últimas décadas en las Américas; la Organización Panamericana de la Salud / Organización Mundial de la Salud (OPS/OMS) el 16 de febrero del 2024 reitera el llamado a los Estados Miembros para intensificar los esfuerzos y las acciones de control del mosquito Aedes aegypti (principal vector transmisor), además de continuar con las acciones de vigilancia, diagnóstico precoz y tratamiento oportuno de casos de dengue.
Dengue: es una enfermedad causada por un virus, que se transmite a través de la picadura de un mosquito: el Aedes aegypti (mosquito pequeño, de color oscuro con patas rayadas negras y blancas).
La hembra del mosquito se infecta luego de alimentarse con sangre de una persona que tiene el virus en su cuerpo (pudiendo tener síntomas o no de la enfermedad) y así, después de unos días el mosquito puede transmitir el virus a otras personas.
El virus del dengue (DENV, acrónimo oficial) es un arbovirus del género Flavivirus de la familia Flaviviridae. Existen cuatro serotipos inmunológicos: DENV-1, DENV-2, DENV-3, y DENV-4 causantes del dengue
Signos y síntomas de Dengue
No todas las personas que sean infectadas con el virus van a desarrollar la enfermedad. Gran parte de las personas serán asintomáticas y otras pueden iniciar con síntomas 5 a 7 días después de la picadura del mosquito.
Los síntomas por lo general son:
Algunos casos de dengue pueden evolucionar a formas graves que requerirán internación para un adecuado manejo de las complicaciones.
En la subregión del Cono Sur, a la que pertenece nuestro país, se notificaron 570.756 casos sospechosos de dengue entre la semana epidemiológica (SE) 1 y la SE 5 de 2024. Esto representa un aumento del 193% en comparación con el mismo período del 2023 y un aumento del 254% en comparación con el promedio de los últimos 5 años.
En Argentina, en lo que va de la temporada 2023/2024 (desde la SE 31/2023 hasta la SE 12/2024, esto es de agosto 2023 a marzo 2024), se registraron 180.529 casos de dengue, de los cuales el 90% son autóctonos. Del total de casos, 163.419 se registraron desde la SE 1 hasta la SE 12 de 2024. La incidencia acumulada hasta el momento para el país en su totalidad es de 384 casos por cada cien mil habitantes.
A continuación se presenta el número de casos totales de dengue en nuestro país por semana epidemiológica (incluye autóctonos, importados y en investigación) en diferentes temporadas epidémicas.
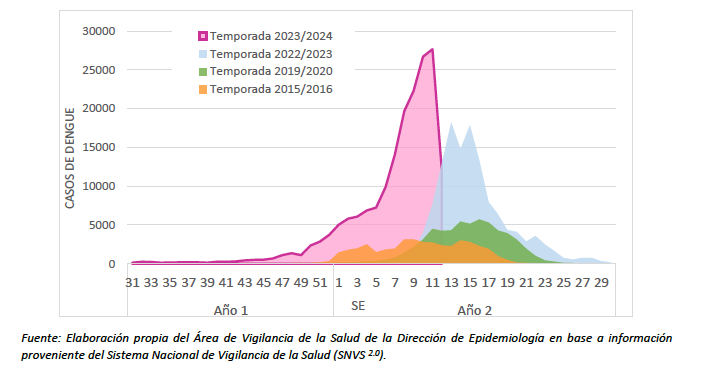
En la actualidad, 19 jurisdicciones en las 5 regiones del país registran circulación viral autóctona de dengue: todas las de las regiones NOA, NEA, Cuyo y Centro, y la provincia de La Pampa en la región Sur. Hasta la SE 12 el mayor número de casos fue aportado por la región del Centro seguida por la región del NEA, mientras que las tasas más elevadas las presenta la región NEA seguidas por NOA y Centro. Las regiones Cuyo y Sur son las que presentan el menor número de casos y las incidencias acumuladas más bajas.
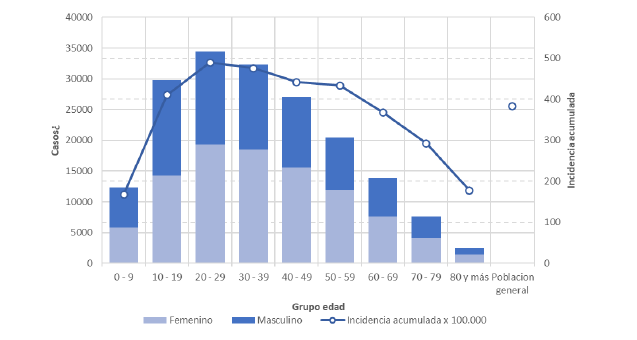
La incidencia acumulada más elevada y el mayor número de casos se observó en personas entre 20 y 39 años. La incidencia más baja se registra en menores de 10 años y mayores de 70 años como puede observarse en la siguiente figura.
El total de fallecidos por dengue durante el periodo SE 31/2023 a SE12/2024 fue de 129. La media de edad de los casos fallecidos fue de 48 años, con un mínimo menor de 1 año y un máximo de 91. Los casos fallecidos se registraron en todos los grupos de edad, con la mayor tasa de mortalidad en los mayores de 80 años seguidos por 70 a 79, 60 a 69 y 30 a 39, mientras que el mayor número de casos se presentó en personas de entre 30 y 39 años.
En la presente temporada se han identificado hasta el momento 3 serotipos circulando en el país, con predominio de DENV-2 (57.86%), seguido de DENV-1 (42.01%) y algunos pocos casos de DENV-3 (0.13%).
Hubo múltiples intentos de generar una vacuna contra el DENV, que incluyen virus recombinantes quiméricos vivos atenuados, virus vivos atenuados, virus inactivados, vacunas de proteínas recombinantes y vacunas de ARN mensajero (ARNm). Cada prototipo de vacuna varía en sus propiedades de atenuación, eficacia y perfil de inmunogenicidad.
En Argentina, en abril del 2023, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT, ente regulador de nuestro país) aprobó la vacuna Qdenga o TAK003 desarrollado por la farmacéutica Takeda de Japón.
Esta vacuna fue diseñada a partir de la cepa atenuada molecularmente caracterizada del serotipo 2 del dengue (DENV-2 PDK-53, TDV-2). Luego, se diseñaron otros tres virus quiméricos recombinantes utilizando el esqueleto TDV-2 (DENV-2) pero con la sustitución de los genes prM y E del DENV-2 por los del DENV-1 16007 (TDV-1), DENV-3 16562 (TDV-3) y DENV-4 1036 (TDV-4) (1). Juntos, TDV1-4, se formulan como la vacuna tetravalente atenuada contra el dengue TAK-003.
Como antecedente, la vacuna DENV-2 PDK-53 sobre la que se desarrolló la tetravalente fue estudiada en Estados Unidos y Tailandia como una vacuna monovalente o como un componente único de las candidatas a vacunas tetravalentes (formulada para los cuatro serotipos de dengue) atenuadas contra el dengue. Estos estudios mostraron que este componente (DENV-2 PDK-53) es seguro, bien tolerado, altamente inmunogénico con inducción de protección a largo plazo frente a infecciones causadas por el serotipo DENV2 (2-4).
Como todas las vacunas que empleamos en población general, la vacuna tetravalente desarrollada a partir de DENV-2 PDK-53 fue objeto de muchos estudios que evalúan entre otros su seguridad, funcionamiento, inmunogenicidad y estabilidad. Se realizaron estudios preclínicos en modelos animales cuyos resultados llevaron a una optimización en la formulación para lograr una respuesta equilibrada para los 4 serotipos de dengue. De hecho, las primeras pruebas clínicas revelaron que los títulos de anticuerpos neutralizantes (nAb) específicos del serotipo inducido por la formulación tetravalente resultaron ser más bajos en comparación con los títulos de nAb inducidos mediante la inmunización monovalente individual.
De los cuatro componentes de DENV de TAK-003, las quimeras de los serotipos DENV3 y DENV4 fueron menos inmunogénicas y reactogénicas que las de DENV1 y DENV2, lo que sugiere interferencia viral entre los serotipos (1). Esto llevó a nuevas evaluaciones para varias formulaciones de vacunas con diferentes proporciones de los cuatro componentes de DENV de forma de superar la debilidad detectada. En estos estudios se observó que las formulaciones de vacunas que comprenden una cantidad equivalente de cada uno de los cuatro serotipos en un esquema de inmunización de 2 dosis (1 inicial y otra de refuerzo) no generaron niveles de nAb adecuados contra DENV4 en el modelo de ratones AG129 ni en el de monos cynomolgus. Sin embargo, los títulos de nAb contra DENV3 y DENV4 mejoraron sustancialmente en formulaciones en las que se incrementaron los niveles de los componentes TDV-3 y TDV-4.
Luego de esta optimización de la formulación tetravalente se procedió a investigar el esquema de inmunización y los intervalos entre vacunaciones en un ensayo clínico de fase 2 a gran escala, aleatorizado, doble ciego y controlado con placebo. Este ensayo, que se realizó luego de pasar exitosamente la fase 1 en la que se analiza la seguridad de la formulación (5,6), tuvo como objetivo determinar la seguridad e inmunogenicidad de tres diferentes esquemas de vacunación: un esquema de dos dosis primarias administrado con un espaciamiento temporal de 3 meses entre primera y segunda dosis, un esquema de una dosis primaria única y un esquema de una dosis primaria y una dosis de refuerzo administrada a los 12 meses de la primera dosis (7). Estos ensayos revelaron que los esquemas de dos dosis, ya sea dos dosis primarias o una primaria y una de refuerzo, son superiores al esquema de una sola dosis para inducir tasas de seropositividad en participantes seronegativos en la línea de base (7).
La eficacia de TAK-003 (optimizada) se evaluó en un ensayo clínico de fase 3, doble ciego, aleatorizado y controlado con placebo. Este ensayo involucró a niños y adolescentes sanos entre las edades de 4 a 16 años en ocho países endémicos de dengue (8,9). Dos dosis de vacuna o placebo se administraron con 3 meses de diferencia. Cada dosis de TAK-003 contenía 4 × 103 (3,6 log10), 1 × 104 (4,0 log10), 4 × 104 (4,6 log10) y 1,2 × 105 (5,1 log10) PFU de TDV-1, TDV-2, TDV-3 y TDV-4, respectivamente. Luego de 12 meses de seguimiento después de la segunda vacunación, la eficacia general en la población fue del 80,9%, con una eficacia del 95,4% contra la hospitalización relacionada con el dengue. La eficacia varió entre los serotipos, con eficacias reportadas del 73,7%, 97,7% y 62,6% contra DENV1, DENV2 y DENV3 respectivamente (9).
Los resultados sobre la eficacia contra DENV-4 fueron inconclusos debido a la baja circulación de DENV-4. En los participantes seronegativos en la línea de base, la eficacia fue del 74,9%, y en aquellos seropositivos en la línea de base, fue del 82,2%. Contra DENV1 y DENV2, la eficacia fue del 79,8% y del 96,5%, respectivamente, entre los participantes expuestos a DENV (previamente con infección por dengue); y fue del 67,2% y del 100%, respectivamente, entre los participantes no expuestos a DENV (sin antecedente de infección previa por dengue). Debido al número limitado de casos de dengue confirmados por DENV-3 y DENV-4, los resultados para DENV-3 y DENV-4 son inconclusos. Los estudios continuaron a más largo plazo y así pudo observarse que a los 18 meses de seguimiento después de la segunda vacunación, la eficacia acumulativa fue del 80,2%. El análisis del período de evaluación secundaria (es decir, entre los 12 y 18 meses) mostró que la eficacia general fue del 73,3%. La eficacia fue del 76,1% en individuos expuestos a DENV y del 66,2% en individuos no expuestos a DENV. Contra la hospitalización relacionada con el dengue y la fiebre hemorrágica del dengue, la eficacia fue del 90,4% y del 85,9%, respectivamente. La eficacia también varió entre los serotipos de DENV: 69,8% para DENV1, 95,1% para DENV2, 48,9% para DENV3 y 51,0% para DENV4. No se observó protección contra DENV3 en individuos seronegativos. Los datos publicados al final de 24 meses de seguimiento después de la vacunación mostraron que la eficacia acumulativa general fue del 72,7%.
La eficacia varió entre los individuos expuestos y no expuestos a DENV. La eficacia específica del serotipo contra DENV1, DENV2 y DENV3 fue del 69,0%, 90,8% y 51,4%, respectivamente. La eficacia contra DENV4 fue inconclusa. Sin embargo, el análisis de la eficacia en el segundo año mostró que la eficacia había disminuido al 56,2%. Esta disminución en la eficacia se atribuyó parcialmente a un cambio en la variación de la dominancia anual del serotipo (10,11). La falta de eficacia contra DENV3 en individuos no expuestos persistió en el segundo año.
Más recientemente, se publicaron datos de seguimiento de 36 meses. TAK-003 demostró una eficacia acumulativa general del 62,0% contra el dengue confirmado virológicamente. Entre los individuos expuestos previamente a DENV, la eficacia fue del 65,0% y entre los individuos no expuestos a DENV, fue del 54,3%. Estos resultados sugieren que la vacuna sigue induciendo una respuesta inmune protectora pero con una disminución gradual desde los 12 meses hasta los 36 meses posteriores a la vacunación. Nuevamente, no se observó protección contra DENV3 en individuos no expuestos previamente a DENV. TAK-003 también condujo a una tasa de hospitalización más alta en individuos no expuestos a DENV debido a DENV3 en comparación con el placebo. Este fenómeno debe ser seguido en futuros estudios, ya que podría ser una señal temprana de ADE en receptores seronegativos cuando están expuestos a DENV3.
Todos estos datos muestran claramente que la vacuna tetravalente fue ampliamente estudiada y cuenta con los datos de seguridad y eficacia para que los entes reguladores la aprueben y los organismos centralizados planteen las recomendaciones.
En nuestro país, luego de la aprobación, la Comisión Nacional de Inmunizaciones (CoNaIn) en su reunión del 7 de marzo de 2024 acordó en los siguientes 4 puntos:
En suma, la vacuna contra el dengue ya aprobada y las nuevas que surjan añaden una herramienta crucial para hacer frente a esta enfermedad, hoy considerada un problema grave de salud.
Dra. Daniela Hozbor: directora del laboratorio Vacunas Salud (VacSal) del Instituto de Biotecnología y Biología Molecular (UNLP-CONICET).











